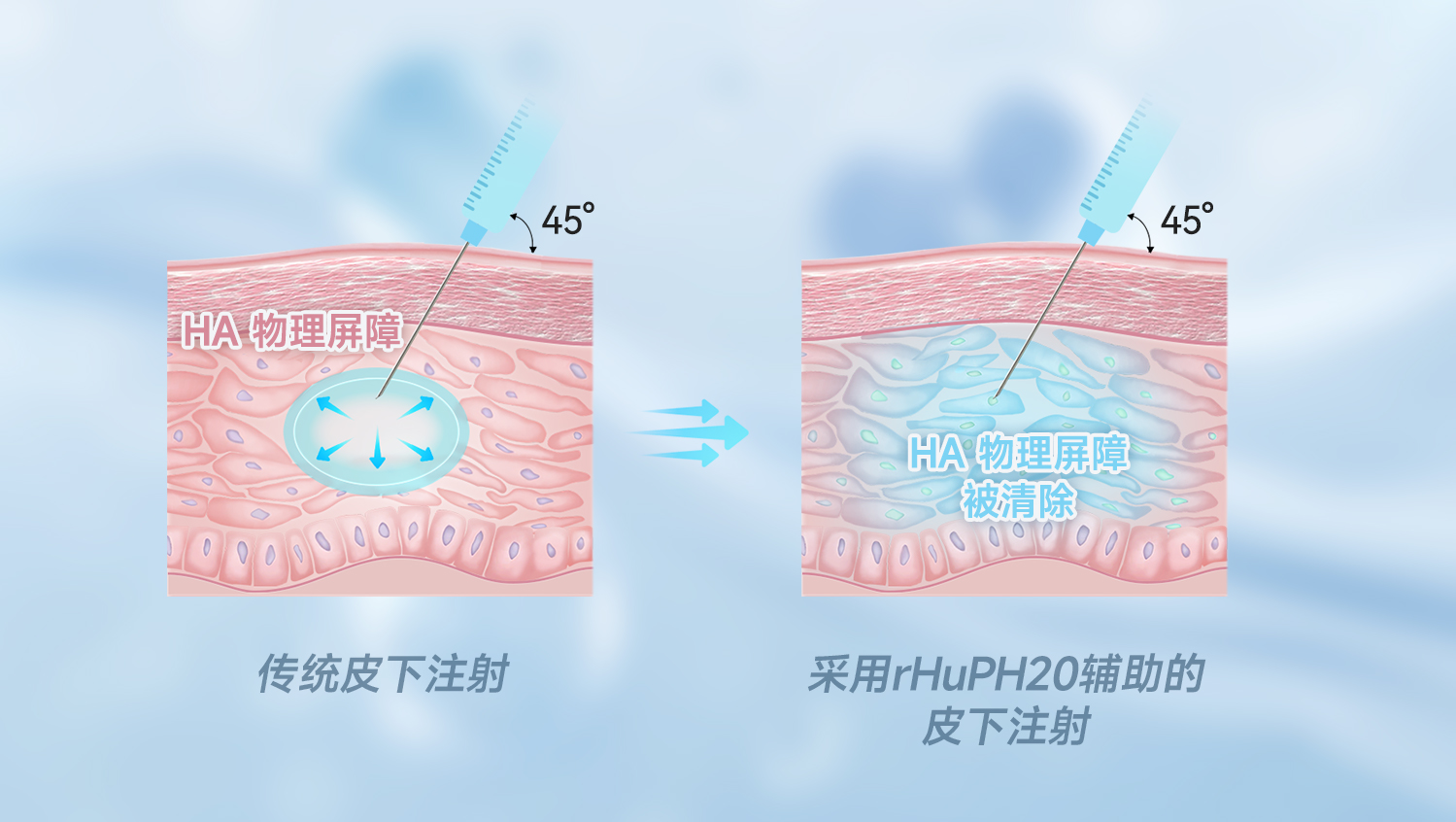
我们的HYSORPTASE®是一种采用哺乳动物细胞体外合成的重组人透明质酸酶(rHuPH20),它能局部降解皮下透明质酸(HA),暂时消除液体流动的障碍,突破皮下只限于2mL给药体积的限制,实现高达1L体积的药物通过皮下安全、高效的被吸收。改善患者体验、提高医疗系统效率、提升合作药物的竞争力。
采用HYSORPTASE®重组人透明质酸酶与生物制剂、小分子药物等开发共制剂,可使共制剂药物突破皮下给药体积限制,实现快速、便捷、安全的高剂量给药,从而为患者、医疗系统和制造商带来益处。
数款采用同类透明质酸酶制剂的皮下给药产品已在全球市场获得认可。
HYSORPTASE®重组人玻璃酸酶已有数百例临床使用的数据:
2024年Q3重组人玻璃酸酶递交上市申请获NMPA受理。
HYSORPTASE®重组人玻璃酸酶共制剂,多个自研和合作抗体处于不同的临床研究阶段:
2024年12月KJ015(自研品种)获NMPA临床试验许可。
2025年06月KJ015(自研品种)在中国启动I期临床试验。
HYSORPTASE®重组人玻璃酸酶辅助下多个品种改良为皮下输注给药,处于不同的临床研究阶段:
2025年02月BJ007获NMPA临床试验许可。
2025年08月BJ007在中国启动临床试验。
2025年09月BJ009获NMPA临床试验许可。
HYSORPTASE®重组人玻璃酸酶药用辅料登记:
2024年11月HYSORPTASE®完成在NMPA药用辅料登记。
2025年05月HYSORPTASE®完成在FDA的DMF登记备案。

宝济药业按照重组药物的质量管理要求开发并生产重组人透明质酸酶Hysorptase®,生产过程符合现行GMP要求,生产规模满足商业化需求。
中国辅料登记号:F20240000658
FDA DMF登记号:041587

有了Hysorptase®重组人透明质酸酶,我们就有可能突破传统皮下注射体积的限制,在医院或家中为有需要的患者提供便捷的可皮下给药的治疗药物。
Hysorptase®重组人透明质酸酶已完成临床验证,可有效促进药物的皮下分散,更有多个共制剂合作项目在各个开发阶段。
